Новости медицины
Учёные МГУ раскрыли структуру ключевого участка фермента «бессмертия и старения»
23/03/2018
Сотрудники МГУ имени М.В. Ломоносова в составе международного коллектива исследователей идентифицировали структуру одного из ключевых участков теломеразы — фермента клеточного бессмертия. Изучение строения этого белка имеет особое значение при разработке препаратов, направленных на лечение рака. Результаты работы опубликованы в высокорейтинговом журнале Nucleic Acids Research.
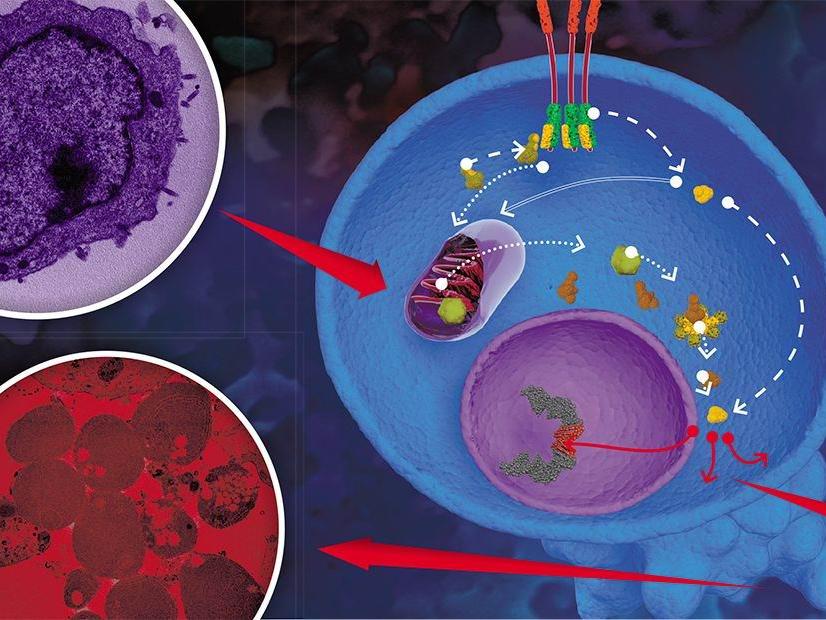
Чтобы обеспечить потомство абсолютно точной копией своего генетического материала, каждая клетка перед делением переживает процесс репликации — удвоения — ДНК. Этот процесс протекает чётко и отлаженно благодаря тонкой работе сложного ферментативного аппарата, однако эукариотические клетки сталкиваются с проблемой концевых участков: из-за особенностей процесса копирования концы молекул ДНК остаются «недосинтезированными», и с каждым клеточным делением ДНК становится всё короче. Но ничего важного не теряется: концевые фрагменты, или теломеры, состоят из тысяч небольших повторяющихся участков, которые не несут наследственной информации. Когда запас теломерных повторов истощается, клетка перестаёт делиться и впоследствии, как правило, погибает. Учёные предполагают, что таков механизм клеточного старения, который необходим для обновления клеток и тканей организма.
Как же справляются с этим «бессмертные» линии и стволовые клетки, дающие жизнь огромному числу потомков? Здесь на помощь приходит фермент теломераза. Он способен вновь наращивать теломерные концы хромосом, тем самым компенсируя их укорочение при клеточном делении. Белковая каталитическая субъединица теломеразы работает в комплексе с молекулой РНК, короткий участок которой используется в качестве шаблона для синтеза теломерных повторов. Учёные из МГУ выяснили структуру фрагмента теломеразы, ответственного за этот процесс.
«Наша работа направлена на структурную характеристику теломеразного комплекса. В живой природе он включает в себя каталитическую субъединицу, молекулу РНК, участок теломерной ДНК и несколько вспомогательных компонентов. Генетически обусловленная аномально низкая активность теломеразы может вызывать серьёзные патогенные состояния (теломеропатии), в то время как её аномальная активация является причиной клеточного «бессмертия» большинства известных видов рака. Информация о структуре теломеразы и взаимоотношениях между её компонентами необходима для понимания функционирования и регуляции этого фермента, а в будущем – для направленного контроля его активности», — рассказывает Елена Родина, доцент кафедры химии природных соединений химического факультета МГУ.
Работая с модельным эукариотическим организмом, термоустойчивыми дрожжами, исследователи определили структуру одного из важнейших доменов теломеразной каталитической субъединицы (TEN-домена) и выяснили, какие его участки отвечают за взаимодействие фермента с молекулой РНК и синтезируемой ДНК. На основании полученных экспериментальных данных учёные построили теоретическую модель каталитического ядра теломеразы. Действие фермента упрощённо можно описать следующим образом. Представим теломеразу в виде молекулярной машины, содержащей РНК-матрицу. Эта машина с помощью части своей матрицы связывается с концом длинной цепи ДНК, а по оставшемуся матричному фрагменту синтезирует фрагмент новой цепи ДНК. После этого теломеразная машина должна переместиться на только что синтезированный конец ДНК с тем, чтобы продолжить наращивать цепь. Согласно предположениям учёных, TEN-домен позволяет теломеразе синтезировать фрагменты ДНК строго определённой длины, после достижения которой матрица теломеразы должна отлипнуть от цепи ДНК, чтобы переместиться ближе к её краю. Таким образом, TEN-домен обеспечивает переход фермента к достройке нового участка — следующего теломерного повтора. Цикл синтеза повторяется.
Кроме того, исследователи идентифицировали структурное ядро TEN-домена, сохранившееся в неизменном виде у самых разных организмов, несмотря на все эволюционные перипетии, что свидетельствует о важной роли этого ядра в функционировании фермента. Также найдены и специфичные для групп организмов элементы, взаимодействующие строго со «своими» белками конкретного теломеразного комплекса.
«Полученные данные приближают нас к пониманию строения, функционирования и регуляции теломеразы. В будущем эти знания могут быть использованы для создания препаратов, направленных на регуляцию теломеразной активности с целью как её повышения (например, для увеличения продолжительности жизни клеток в биоматериалах для трансплантологии), так и снижения (например, для того чтобы бессмертные раковые клетки теряли свойство бессмертия)», — заключает Елена Родина.
Работа выполнена при поддержке Российского научного фонда учёными химического факультета и факультета фундаментальной медицины МГУ совместно с сотрудниками Казанского федерального университета, Сколковского института науки и технологий, Московского физико-технического института, Европейской лаборатории молекулярной биологии в Германии и Лаборатории Резерфорда – Эплтона в Англии.
Источник
Чтобы обеспечить потомство абсолютно точной копией своего генетического материала, каждая клетка перед делением переживает процесс репликации — удвоения — ДНК. Этот процесс протекает чётко и отлаженно благодаря тонкой работе сложного ферментативного аппарата, однако эукариотические клетки сталкиваются с проблемой концевых участков: из-за особенностей процесса копирования концы молекул ДНК остаются «недосинтезированными», и с каждым клеточным делением ДНК становится всё короче. Но ничего важного не теряется: концевые фрагменты, или теломеры, состоят из тысяч небольших повторяющихся участков, которые не несут наследственной информации. Когда запас теломерных повторов истощается, клетка перестаёт делиться и впоследствии, как правило, погибает. Учёные предполагают, что таков механизм клеточного старения, который необходим для обновления клеток и тканей организма.
Как же справляются с этим «бессмертные» линии и стволовые клетки, дающие жизнь огромному числу потомков? Здесь на помощь приходит фермент теломераза. Он способен вновь наращивать теломерные концы хромосом, тем самым компенсируя их укорочение при клеточном делении. Белковая каталитическая субъединица теломеразы работает в комплексе с молекулой РНК, короткий участок которой используется в качестве шаблона для синтеза теломерных повторов. Учёные из МГУ выяснили структуру фрагмента теломеразы, ответственного за этот процесс.
«Наша работа направлена на структурную характеристику теломеразного комплекса. В живой природе он включает в себя каталитическую субъединицу, молекулу РНК, участок теломерной ДНК и несколько вспомогательных компонентов. Генетически обусловленная аномально низкая активность теломеразы может вызывать серьёзные патогенные состояния (теломеропатии), в то время как её аномальная активация является причиной клеточного «бессмертия» большинства известных видов рака. Информация о структуре теломеразы и взаимоотношениях между её компонентами необходима для понимания функционирования и регуляции этого фермента, а в будущем – для направленного контроля его активности», — рассказывает Елена Родина, доцент кафедры химии природных соединений химического факультета МГУ.
Работая с модельным эукариотическим организмом, термоустойчивыми дрожжами, исследователи определили структуру одного из важнейших доменов теломеразной каталитической субъединицы (TEN-домена) и выяснили, какие его участки отвечают за взаимодействие фермента с молекулой РНК и синтезируемой ДНК. На основании полученных экспериментальных данных учёные построили теоретическую модель каталитического ядра теломеразы. Действие фермента упрощённо можно описать следующим образом. Представим теломеразу в виде молекулярной машины, содержащей РНК-матрицу. Эта машина с помощью части своей матрицы связывается с концом длинной цепи ДНК, а по оставшемуся матричному фрагменту синтезирует фрагмент новой цепи ДНК. После этого теломеразная машина должна переместиться на только что синтезированный конец ДНК с тем, чтобы продолжить наращивать цепь. Согласно предположениям учёных, TEN-домен позволяет теломеразе синтезировать фрагменты ДНК строго определённой длины, после достижения которой матрица теломеразы должна отлипнуть от цепи ДНК, чтобы переместиться ближе к её краю. Таким образом, TEN-домен обеспечивает переход фермента к достройке нового участка — следующего теломерного повтора. Цикл синтеза повторяется.
Кроме того, исследователи идентифицировали структурное ядро TEN-домена, сохранившееся в неизменном виде у самых разных организмов, несмотря на все эволюционные перипетии, что свидетельствует о важной роли этого ядра в функционировании фермента. Также найдены и специфичные для групп организмов элементы, взаимодействующие строго со «своими» белками конкретного теломеразного комплекса.
«Полученные данные приближают нас к пониманию строения, функционирования и регуляции теломеразы. В будущем эти знания могут быть использованы для создания препаратов, направленных на регуляцию теломеразной активности с целью как её повышения (например, для увеличения продолжительности жизни клеток в биоматериалах для трансплантологии), так и снижения (например, для того чтобы бессмертные раковые клетки теряли свойство бессмертия)», — заключает Елена Родина.
Работа выполнена при поддержке Российского научного фонда учёными химического факультета и факультета фундаментальной медицины МГУ совместно с сотрудниками Казанского федерального университета, Сколковского института науки и технологий, Московского физико-технического института, Европейской лаборатории молекулярной биологии в Германии и Лаборатории Резерфорда – Эплтона в Англии.
Источник
Написать нам
Меню
Наши контакты
117420, Москва, улица Наметкина, 10Б, строение 1
Medrating